|
|
Hibridação de orbitais atômicos
Hibridização
Abaixo temos as configurações eletrônicas dos elementos: Berílio (Z = 4), boro (Z = 5), e carbono (Z= 6), átomo que no estado gasoso fica isolado.
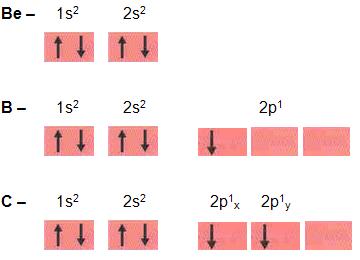
A partir dessas configurações conclui-se que:
- berílio é um elemento inerte.
- para o boro é possível apenas formar apenas uma ligação com outros átomos.
- para o carbono é possível Formar duas ligações com outro átomo.
Porém, não é possível que ocorra tais possibilidades acima:
- pois o berílio constitui compostos como o BeCl2.
- o boro constitui composto como o BF3.
- o carbono constitui milhões de compostos, e esses se ligam a quatro átomos.
Desta forma obteremos o que chamamos de hibridação ou hibridização de orbitais.
Hibridação sp3
A partir dessa observação sabe-se que o átomo de carbono possui quatro valências equivalentes. Denominamos estado fundamental a configuração do átomo de carbono quando se encontra em estado isolado.
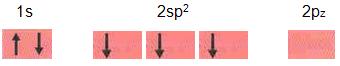
Hibridação sp2
Pode ocorrer
- Relação do orbital s com dois orbitais p, da mesma forma que ocorre com o boro. Vejamos alguns exemplos:
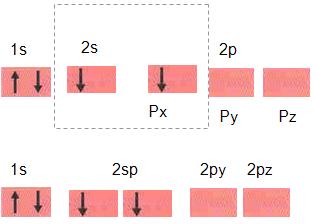
- Estado fundamental
A estrutura abaixo revela que o boro é monovalente.

- Estado ativado
 - Estado hibridizado
- Estado hibridizado
Hibridação sp
A relação entre um orbital s e um orbital p, onde os dois orbitais possuem o mesmo formato, que é semelhante a um queijo provolone, estando na mesma reta, portanto conclui-se que eles são iguais.
Por exemplo:

Segundo o estado fundamental não é possível que o berílio faça ligações. Vejamos:
Analisando a figura acima, é possível perceber que os três orbitais híbridos sp2 são idênticos, eles possuem a mesma forma, estão no mesmo plano, e os eixos estão a 120º entre eles mesmos.
Em uma perpendicular do plano do triângulo encontramos o orbital pz. Possuem o um formato triangular e plano as moléculas da espécie BF3, BCl3, as moléculas AlCl3, AlF3 possuem o formato plano triangular, semelhante ao boro temos o alumínio (Z = 13).
Os orbitais Py e Pz, não podem ser alterados, eles estão em uma posição perpendicular entre eles mesmos.
Outros casos de hibridização
A hibridização não é dependente da ativação, desta forma é possível formar orbitais híbridos, onde também não é possível a ativação de átomos, como por exemplo, nitrogênio, entre outros.
O que diferencia a hibridização do nitrogênio e do carbono, por exemplo, é que no nitrogênio o híbrido formado é sp3 , o orbital 2s completo é apresentado pelo carbono.
Não é regular a configuração tetraédrica que se pretendia para os orbitais sp3 do nitrogênio, pelo fato de que os três orbitais ter apenas 1 elétron, forma-se ângulos menores de 109º 18°.
Vejamos um exemplo, da molécula de NH3.
O ângulo resultante foi construído pelos orbitais do nitrogênio.
É importante sabermos que o ângulo do nitrogênio forma 107°.
N: 1s2 2s2 1p3.
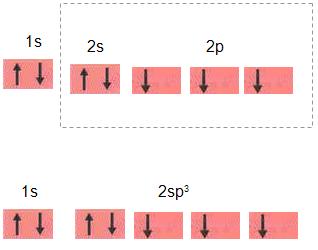
Orbital completo de híbridos sp3 do N.
Pirâmide trigonal da molécula da amônia.
Quando a molécula de amônia se liga a um próton, ocorre a formação do íon de amônia; Tetraédrico, íon de amônio:
É importante lembrar que as representações de híbridos que foram produzidas para nitrogênio e oxigênio, podem ser utilizadas para os outros elementos dos seus grupos, como por exemplo, pelos átomos cereais, ou seja, oxigênio, enxofre, selênio, telúrio, nitrogênio, fósforo, arsênio, antimônio.
Observe a tabela abaixo, que nos mostra alguns ângulos que foram feitos pelo átomo central com átomos de hidrogênio, isso ocorreu em alguns hidretos.
Estrutura do PCl5
Fósforo - Z = 15
Onde no seu estado fundamental, sua configuração é a seguinte:

Trivalente, por conter 3 elétrons não-emparelhados.
Observe o exemplo:
PCl5 (pentacloreto de sódio), ocorreu que o fósforo constituiu 5 ligações covalentes.
Para que ocorram essas ligações é preciso que 5 elétrons não estejam emparelhados, para isso é necessário que um elétron do orbital 3s passe para o orbital 3d. Vejamos:
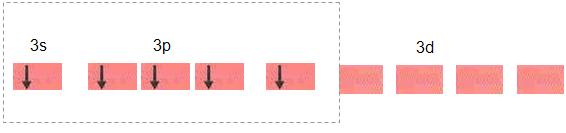
Os cinco orbitais dsp3 foram formados pela hibridização dos orbitais 3s, dos três orbitais 3p e um 3d, esses novos orbitais são conduzidos para o vértice de uma bipirâmide trigonal.

O formato da molécula de PCl5, (pentacloreto de fósforo) é de uma bipirâmide trigonal, que possui o núcleo do fósforo centralizado, nos 5 vértices podemos encontrar os núcleos dos átomos de cloro.
Estrutura do SF6
Enxofre - Z = 16
Onde no seu estado fundamental apresenta 2 elétrons não-emparelhados, contendo a seguinte configuração:

O enxofre é bivalente, vejamos:
Ocorrem 6 ligações covalentes no SF6 (hexafluoreto de enxofre), constituindo assim 6 ligações covalentes.
Dois dos orbitais 3d recebem um elétron do orbital 3s e um elétron do orbital 3p.
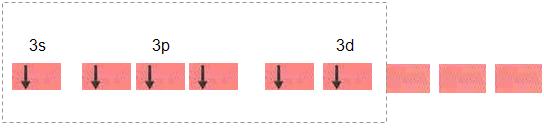
Os orbitais d2sp3 foram constituidos a partir da hibridação desses seis orbitais, esses novos orbitais se locomovem para os vértices de um octaedro.

SF6 é uma molécula octaédrica
|
Nenhum comentário:
Postar um comentário